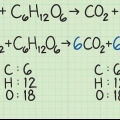
Om det finns siffror bredvid reaktanterna är dessa koefficienterna. Dessa representerar förhållandet i vilket reaktanterna är inkorporerade. Den begränsande reaktanten är utgångsmaterialet som tar slut först. Vid reaktioner med flera utgångsmaterial avbryts reaktionen så snart ett av utgångsmaterialen är förbrukat, om inte alla utgångsmaterial tas upp i samma proportion. 
För att beräkna molmassan för en molekyl lägger du ihop atommassorna för varje atom i ämnet. Atommassan är talet under den kemiska symbolen i det periodiska systemet. Kom ihåg att alla nedsänkta nummer för en molekyl betyder att dessa atomer är vanligare. 
Om det faktiska förhållandet är större än det stökiometriska, så är reaktanten i täljaren störst, vilket betyder att den andra reaktanten är den begränsande faktorn. Om det faktiska förhållandet är mindre än det stökiometriska, så är reaktanten i täljaren bara den begränsande faktorn. 
Du beräknar antalet mol av ett ämne som produceras av givna reaktanter, genom att multiplicera antalet mol av en reaktant med förhållandet koefficient produkt / koefficient för reaktanten. Gör detta för varje reaktant. 







Beräkna reaktionsutbytet
Inom kemi är reaktionsutbyte om det reaktionseffektivitet mängden ämne som produceras av en kemisk reaktion. Det teoretisk avkastning är den maximala mängd ämne som kan produceras i en perfekt effektiv reaktion. I verkligheten är de flesta reaktioner långt ifrån perfekta – effektiviteten av en reaktion är vanligtvis mindre än vad som är teoretiskt möjligt. För att uttrycka effektiviteten av en reaktion, beräkna reaktionseffektiviteten med formeln: % avkastning = (faktisk avkastning/teoretisk avkastning) x 100.
Steg
Del 1 av 3: Bestäm den begränsande reaktanten

1. Börja skriva den kemiska ekvationen. Detta kommer att fungera som en matematisk representation av den slutliga reaktionen.
- Om du inte är säker på hur man skriver en kemisk ekvation, se wikiHow om detta ämne.

2. Bestäm vilka reaktanter du har att göra med. Dessa är vanligtvis till vänster om pilen i ekvationen. Dessa benämns också med termen "utgångsmaterial." Det är möjligt (som i del 2) att det bara finns en reaktant.

3. Beräkna mängden (i mol) av varje reaktant. För att göra detta, dividera massan av varje reaktant med dess molära massa.

4. Om du har två reaktanter, jämför förhållandet mellan molerna och koefficienterna. Dessa förhållanden kallas respektive "faktiska förhållandet" och "stökiometriskt förhållande."

5. Om du har mer än två reaktanter måste du beräkna hur många mol av varje reaktant som kommer att producera när reaktionen är klar. Den reaktant som producerar den lägsta mängden är den begränsande faktorn.
Del 2 av 3: Beräkna den teoretiska avkastningen

1. Bestäm vad som ska vara produkten av en reaktion. Detta är vanligtvis på höger sida av pilen i en kemisk formel. I detta exempel är CaO det önskade ämnet (CO2 är en gas). Det teoretiska utbytet är ett mått på mängden produkt vi förväntar oss om reaktionen är fullt effektiv.
- Till exempel: Clair gör 0,45 g ammoniumnitrat. Hon förutspår ett teoretiskt utbyte på 0,50 g. Vad är den procentuella avkastningen?
- 0,45/0,50= 0,9. Multiplicera detta med 100 för procentsatsen.
- Procentuell avkastning = 90 %. Skriv ner massan av vart och ett av dina utgångsämnen.

2. Konvertera massan av den begränsande reaktanten till antalet mol. Gör detta genom att dividera reaktantens massa med molmassan, som i steg 3, dividera 1.

3. Det experimentella förhållandet. Dela molerna av den önskade produkten med molerna av den begränsande reaktanten. Detta kallas det experimentella förhållandet.

4. Beräkna molmassan för 1 mol av produkten. Anteckna detta förhållande i ekvationen, som beskrivs nedan.

5. Förutsäg den teoretiska avkastningen. Multiplicera antalet mol av den begränsande reaktanten med förhållandet (produktkoefficient / koefficient för begränsande reaktant) och multiplicera med produktens molära massa. Detta ger dig massan av produkten du kommer att producera, om reaktionen alls är perfekt effektiv (enligt det teoretiska utbytet).
Del 3 av 3: Beräknar den procentuella avkastningen

1. Låt reaktionen ske. Samla upp den renade produkten från din reaktion och beräkna dess massa på en våg. Notera massan.

2. Omvandla produktens massa till mol genom att dividera med molekylvikten. Detta gör du på samma sätt som i steg 2, del 2. Anteckna antalet mol av ämnet som erhållits under experimentet som det faktiska utbytet.

3. Beräkna den procentuella avkastningen. Dividera den faktiska avkastningen med den teoretiska avkastningen och multiplicera med 100. Svaret är en procentsats som jämför produktens massa med massan av en idealisk (perfekt) reaktion.
Varningar
- Det är möjligt att beräkna en procentuell avkastning som är större än 100 %, utan att göra ett misstag i din beräkning. Om slutprodukten du väger inte är ren (den innehåller ämnen som inte togs med i den kemiska jämförelsen), blir resultatet inte korrekt.
- Det är därför det är viktigt att noggrant rena din produkt genom filtrering, torkning, destillation eller på annat sätt, beroende på produktens egenskaper.
"Beräkna reaktionsutbytet"
Оцените, пожалуйста статью