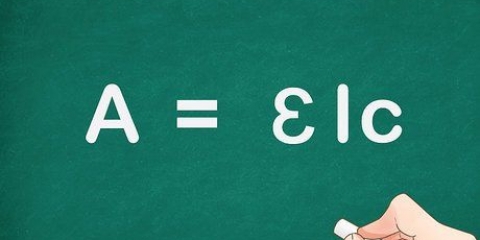Exempeluppgift: Mol = 0,75 mol NaCl Volym = 4,2 L 
Exempelproblem: molaritet = 0,75 mol / 4.2L = 0,17857142 
Exempeluppgift: 0,179 M NaCl 

Exempeluppgift: Massa = 3,4 g KMnO4 Volym = 5,2 L 
Exempeluppgift: Molmassan av K = 39,1 g Den molära massan av Mn = 54,9 g Den molära massan av O = 16,0 g Total molmassa = K + Mn + O + O + O + O = 39,1 + 54.9 + 16 + 16 + 16 + 16 = 158,0 gram 
Exempelproblem: gram ämne * (1/molar massa av ämnet) = 3,4 g * (1 mol / 158 g) = 0,0215 mol 
Exempelproblem: molaritet = 0,0215 mol / 5.2L = 0.004134615 
Exempeluppgift: 0,004 M KMnO4 

Exempeluppgift: Antal mol = 1,2 mol CaCl2 Volym = 2905 ml 
Exempelpåstående: 2905 ml * (1 L / 1000 ml) = 2905 L 
Exempeluppgift: 1,2 mol CaCl2 / 2905L = 0,413080895 
Exempeluppgift: 0,413 M CaCl2 

Den molära massan av Na = 22,99 g Den molära massan av Cl = 35,45 g Den molära massan av NaCl = 22,99 + 35.45 = 58,44 gram 
Mol NaCl = 5,2 g NaCl * (1 mol / 58,44 g) = 0,08898 mol = 0,09 mol 
Du kan också se detta som att multiplicera 800 ml med en omvandlingsfaktor på 1 L / 1000 ml. För att göra detta snabbt, allt du behöver göra är att flytta decimalkomma 3 siffror till vänster, istället för att beräkna detta. Volym = 800 ml * (1 L / 1000 ml) = 800 ml / 1000 ml = 0,8 L 
Molaritet = antal mol ämne / antal liter lösning = 0,09 mol / 0,8 L = 0,1125 mol/L 
Svar: 0,11 M NaCl
Beräkna molariteten för en lösning
Molaritet är en beskrivning av förhållandet mellan antalet mol av en vätska och dess volym. För att beräkna molaritet börjar man med mol och volym, massa och volym eller mol och milliliter. Dessa variabler fylls sedan i i standardformeln för beräkning av molaritet för att (förhoppningsvis) få rätt svar.
Steg
Metod 1 av 4: Beräkna molaritet med hjälp av mol och volym

1. Lär dig standardformeln för beräkning av molaritet. Molariteten är lika med antalet mol av ett löst ämne dividerat med volymen av lösningen i liter. Detta är redan skrivet: molaritet = antal mol ämne / antal liter lösning
- Exempeluppgift: Vad är molariteten för en lösning av 0,75 mol NaCl i 4,2 liter vatten?

2. Se uppdraget. För att beräkna molaritet krävs ett visst antal mol ämne och antal liter lösning. Om uttalandet innehåller dessa siffror behöver inget förberedande arbete göras.

3. Dividera antalet mol med antalet liter. Den fraktion du får ger då antalet mol per liter lösning, även känd som molariteten.

4. Skriv ditt svar. Fyll i svaret korrekt, beroende på dina mätdata och kraven på problemet. Korta ordet "molaritet" av med "m" och använd det lösta ämnets kemiska namn.
Metod 2 av 4: Beräkna molaritet med massa och volym

1. Du känner till standardformeln för att beräkna molaritet.molaritet = antal mol ämne / antal liter lösning
- Exempelproblem: Vad är molariteten för en lösning genom att lösa upp 3,4 g KMnO4 i 5,2 liter eller vatten?

2. Se uppdraget. För att beräkna molaritet krävs ett visst antal mol ämne och antal liter lösning. Om utlåtandet inte ger dessa siffror måste ett visst förarbete göras innan du kan fortsätta.

3. Bestäm molmassan av det lösta ämnet. För att hitta molerna av det lösta ämnet är det nödvändigt att först beräkna molmassan. Du gör detta genom att lägga ihop de olika molära massorna för varje element i ämnet. Denna molära massa kan hittas genom att använda det periodiska systemet.

4. Konvertera gram till mol. Nu när du vet molmassan av det lösta ämnet är det fortfarande nödvändigt att omvandla detta till antalet mol. Det gör du genom att bestämma vad 1 mol av ämnet väger och sedan multiplicera detta med molmassan.

5. Dividera antalet mol med antalet liter lösning för att hitta molariteten.

6. Skriv ditt svar. Fyll i svaret korrekt, beroende på dina mätdata och kraven på problemet. Korta ordet "molaritet" av med "m" och använd det lösta ämnets kemiska namn.
Metod 3 av 4: Beräkna molaritet med hjälp av mol och milliliter

1. Du känner till standardformeln för att beräkna molaritet.molaritet = antal mol ämne / antal liter lösning. Om volymen anges i milliliter måste du konvertera den.
- Exempelproblem: Vad är molariteten för en lösning av 1,2 mol CaCl2 i 2905 milliliter vatten?

2. Se uppdraget. För att beräkna molaritet krävs ett visst antal mol ämne och antal liter lösning. Om utlåtandet inte ger dessa siffror måste ett visst förarbete göras innan du kan fortsätta.

3. Konvertera antalet milliliter till liter. Hitta antalet liter av lösningen genom att dividera volymen med 1000, eller flytta decimaltecknet 3 siffror åt vänster.

4. Dividera antalet mol med antalet liter. Nu när du har alla siffror på rad kan du beräkna lösningens molaritet.

5. Skriv ditt svar. Fyll i svaret korrekt, beroende på dina mätdata och kraven på problemet. Korta ordet "molaritet" av med "m" och använd det lösta ämnets kemiska namn.
Metod 4 av 4: Extra övningsproblem

1. Vi vill bestämma molariteten för en lösning av 5,2 g NaCl i 800 ml vatten. Lista först dessa värden för tydlighetens skull: massa i gram och volym i milliliter.
- Massa = 5,2 g NaCl
- Volym = 800ml vatten

2. Bestäm den molära massan av NaCl. Du gör detta genom att lägga till den molära massan av natrium (Na) och den molära massan av klor (Cl).

3. Multiplicera ämnets massa med omvandlingsfaktorn för molmassan. I det här exemplet är molmassan av NaCl 58.44 g, så du har 1 mol / 58,44 g.

4. Dela 800 ml vatten med 1000 för att få antalet liter.

5. Dela mol av ett ämne med liter av lösningen. För att hitta molariteten, dividera 0,09 mol av ämnet NaCl med 0,8 L av lösningen.

6. Gör ditt svar snyggare. Avrunda ditt svar till två eller tre decimaler och förkorta molaritet till "M.”
"Beräkna molariteten för en lösning"
Оцените, пожалуйста статью