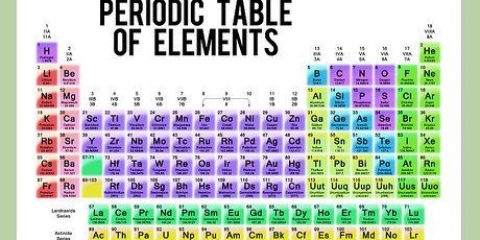
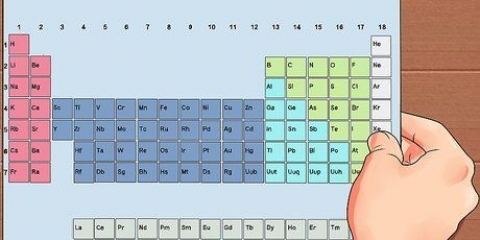
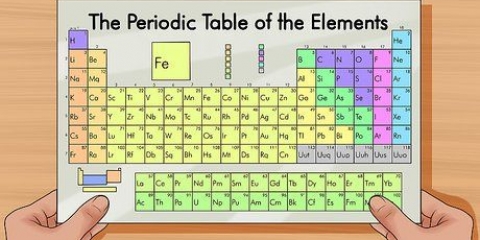
Använd termen "läsa ner en grupp" för att läsa uppifrån och ned. Numreringen anges vanligtvis ovanför kolumnerna; men det kan också falla under andra grupper, såsom metallerna. Numreringen som används i det periodiska systemet skiljer sig mycket. De kan vara romerska (IA), arabiska (1A) eller siffrorna 1 till 18. Väte kan finnas i halogenfamiljen och alkalimetallerna, eller båda. 
Perioder är vanligtvis numrerade 1 till 7 på vänster sida av tabellen. Varje period är större än den föregående. Detta är relaterat till att öka energinivåerna för atomerna i det periodiska systemet. 
Gruppen metaller har en färg. Väte har dock ofta samma färg och grupp som icke-metallerna. Metaller har lyster, är vanligtvis fasta vid rumstemperatur, leder värme och elektricitet och är formbara och formbara. Icke-metaller har samma färg. Dessa är grundämnena C-6 till Rn-86, inklusive H-1 (väte). De har ingen glans, leder värme och elektricitet och är inte formbara. De bildar vanligtvis en gas vid rumstemperatur och kan vara fast, gas eller vätska. Halvmetaller/metalloider har vanligtvis en lila eller grön färg, som en kombination av de andra två färgerna. Linjen är diagonal och sträcker sig från elementen B-5 till At-85. De har vissa egenskaper hos metaller och några av icke-metaller. 
Numreringen kan vara romerska, arabiska eller standardsiffror. 





Observera att det finns ett undantag från denna regel. Om atomen förlorar eller får elektroner blir den en elektriskt laddad jon. Om det finns ett plustecken bredvid elementets symbol indikerar det att det är positivt laddat. Med en minussymbol är den negativt laddad. Om den inte har ett plus- eller minussymbol och ditt kemiproblem inte handlar om joner, är antalet protoner och elektroner förmodligen lika. 


Till exempel: järnets atommassa är 55,847, så masstalet är 56. Elementet har 26 protoner. 56 (massatal) minus 26 (protoner) är 30. Det finns vanligtvis 30 neutroner i en enda järnatom. Att ändra antalet neutroner i en atom bildar isotoper, som är tyngre eller lättare versioner av atomen.
Förstå grundämnenas periodiska system
Det periodiska systemet för grundämnen är en lista över de 118 grundämnen som hittills upptäckts. Det finns flera symboler och siffror som indikerar skillnaderna i elementen, medan tabellens struktur organiserar elementen efter likheter. Du kan läsa det periodiska systemet med hjälp av riktlinjerna nedan.
Steg
Del 1 av 4: Förstå strukturen

1. Tänk på att det periodiska systemet börjar längst upp till vänster och slutar i slutet av den sista raden, längst ner och till höger. Tabellen är strukturerad från vänster till höger i ordning efter ökande atomnummer. Atomnumret är antalet protoner i en enda atom.
- Inte varje rad eller kolumn är komplett. Även om det kan finnas luckor i mitten, fortsätt att läsa tabellen från vänster till höger. Till exempel har väte atomnummer 1 och finns i det övre vänstra hörnet. Helium har atomnummer 2 och ligger i det övre högra hörnet.
- Element 57 till 71 är vanligtvis avbildade som en delmängd i det nedre högra hörnet av tabellen. Dessa är de "sällsynta jordartselementen".

2. I varje kolumn i tabellen hittar du en "grupp" av element. Det finns 18 kolumner.

3. I varje rad i tabellen hittar du elementens `perioder`. Det finns 7 perioder. Använd uttrycket "läsa längs en period" för att läsa från vänster till höger.

4. Förstå de ytterligare grupperna till metall, halvmetall och icke-metall. Färgerna varierar mycket.

5. Vet att elementen ibland anges i familjer också. Dessa är alkalimetallerna (1A), alkaliska jordartsmetaller (2A), halogener (7A), ädelgaser (8A) och kolatomer (4A).
Del 2 av 4: Förstå symbolen och namnge

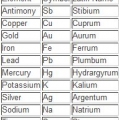
1. Läs symbolen först. Den består av en eller två bokstäver och är standard på flera språk.
- Symbolen kan härledas från det latinska namnet på elementet eller det vanliga vanliga namnet.
- I många fall följer symbolen den engelska namnkonventionen, som Helium, aka `He`. Det är dock ingen regel som man kan utgå ifrån. Till exempel är järn "Fe". Av denna anledning kommer symbol/namnkombinationen vanligtvis ihåg för snabb referens.

2. Titta på det vanliga namnet. Detta är direkt under symbolen. Det skiljer sig beroende på vilket språk det periodiska systemet är skrivet på.
Del 3 av 4: Avläsning av atomnumret

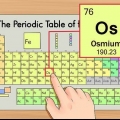
1. Läs det periodiska systemet enligt atomnumret högst upp i mitten av rutan för varje grundämne. Som nämnts tidigare är systemet beställt från övre vänster till nedre höger. Att känna till atomnumret är det snabbaste sättet att slå upp mer information om grundämnet.

2. Atomnumret är antalet protoner i kärnan i en enskild atom av elementet.

3. Att lägga till eller ta bort protoner skapar ytterligare ett element.

4. Att ta reda på antalet protoner i en atom bestämmer också antalet elektroner. Atomer har samma antal elektroner som protoner.
Del 4 av 4: Avläsning av atommassan

1. Bestäm atommassan. Detta är numret under elementets vanliga namn.
- Även om det kan tyckas att atommassan ökar från systemets övre vänstra del till nedre högra hörnet, är detta inte sant i alla fall.

2. Förstå att de flesta element visas med decimaler. Atommassan är summan av partiklarna i kärnan; det är dock ett viktat medelvärde av de olika isotoperna.

3. Använd atommassan för att hitta antalet neutroner i en enda atom. Avrunda atommassan till närmaste heltal, masstalet. Sedan subtraherar du antalet protoner från masstalet för att hitta antalet neutroner.
"Förstå grundämnenas periodiska system"
Оцените, пожалуйста статью