Om det är en decimal tittar du förmodligen på atommassan. 
Det kan finnas ett tomt utrymme efter elementen 56 (barium) och 88 (radium). Det finns faktiskt inte ett utrymme; grundämnena med atomnumren som hör där finns i två rader under resten av systemet. Den enda anledningen till att de är åtskilda så är att göra det periodiska systemet mindre brett. 
För att uttrycka det på ett annat sätt, alla atomer med åtta protoner är en syreatom. Två syreatomer kan ha olika antal neutroner eller (om en är en jon) olika antal elektroner, men båda kommer alltid att ha åtta protoner. 

I praktiken ges atommassan vanligtvis redan för kemiproblem som handlar om endast en atom. Förstå detta koncept för att inte bli förvånad om det skiljer sig från atomvikten. 
Detta fungerar eftersom neutroner och protoner båda är nära 1 AMU och elektroner är nära 0 AMU. För atomvikten används exakta mätningar för att erhålla decimaltalet, men vi är bara intresserade av de heltal som säger oss antalet protoner och neutroner. Kom ihåg att om du använder atomvikten får du ett genomsnitt för ett typiskt prov. Ett bromprov har ett masstal på cirka 80, men som det visar sig har en enda bromatom nästan alltid ett masstal av 79 eller 81. 
En heliumatom (He) har masstalet 4 och atomnumret 2. Därför måste det vara 4 - 2 = 2 neutroner att ha. Ett silverprov (Ag) har ett masstal på cirka 108 (enligt det periodiska systemet) och ett atomnummer på 47. I genomsnitt har varje silveratom i provet 108 - 47 = 61 neutroner. 
Isotoper har inte ett annat atomnummer. Varje isotop av ett grundämne har samma antal protoner.
Bestäm atomnumret för ett grundämne
Atomnumret för ett grundämne är antalet protoner i kärnan av en enda atom av det grundämnet. Atomnumret för ett grundämne eller isotop ändras inte, så du kan använda atomnumret för att beräkna andra egenskaper hos ett grundämne eller isotop, såsom antalet neutroner.
Steg
Del 1 av 2: Hitta atomnumret

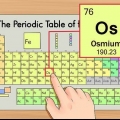
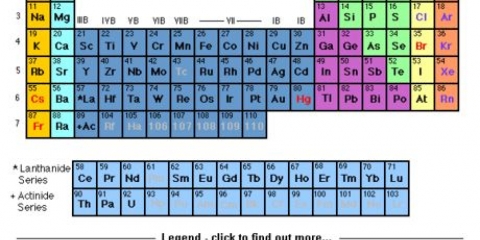
1. Hitta en kopia av det periodiska systemet. Du kan hitta en här om du inte har en till hands. Varje grundämne har olika atomnummer, så det finns inga snabba och enkla metoder att tillämpa. Du måste hitta antingen en kopia av det periodiska systemet eller en måste lära sig utantill.
- De flesta kemiböcker har ett periodiskt system tryckt på omslagets insida.

2. Hitta elementet du studerar. De flesta periodiska system innehåller de fullständiga namnen på de olika grundämnena, såväl som deras kemiska symboler (som Hg för kvicksilver). Om du har problem med att hitta elementet bör du söka online efter "kemisk symbol" följt av namnet på elementet.

3. Hitta atomnumret. Atomnumret finns vanligtvis i det övre vänstra eller högra hörnet av lådan elementet är i, men det kan också vara någon annanstans i rutan. Atomnumret är alltid ett heltal.

4. Verifiera mot angränsande element. Det periodiska systemet är ordnat efter atomnummer. Om ditt grundämnes atomnummer är `33`, så ska elementet till vänster vara `32` och elementet till höger ska vara `34`. Om denna ordning är korrekt har du definitivt hittat atomnumret.

5. Förstå vad atomnumret är. Det finns en enkel definition för atomnumret för ett grundämne: antalet protoner i en atom av det elementet. Detta är den grundläggande definitionen av ett element. Antalet protoner bestämmer kärnans totala elektriska laddning, som bestämmer hur många elektroner en atom kan ha. Eftersom elektroner är ansvariga för nästan alla kemiska reaktioner, bestämmer atomnumret indirekt nästan alla fysikaliska och kemiska egenskaper hos ett grundämne.
Del 2 av 2: Hitta relaterad information

1. Att hitta atomvikten. Atomvikten skrivs vanligtvis ut under namnet på det aktuella grundämnet i det periodiska systemet och beräknas vanligtvis med två eller tre decimaler. Detta är den genomsnittliga massan av en atom i grundämnet, justerad för att matcha vad du förmodligen möter i naturen. Detta nummer är i "atomic mass units" (AMU (från engelska "atomic mass unit")).
- Vissa forskare använder termen "relativ atommassa" istället för "atomvikt".

2. Förstå vad atommassan är. Atommassa är ett begrepp som mycket liknar det för atomvikt. Den enda skillnaden är att du talar om en specifik atom istället för genomsnittet av ett prov. Ett gram järn innehåller många atomer med massor som skiljer sig något från varandra, så du letar efter `relativ vikt` för att hitta medelvärdet. Om du bara är intresserad av en specifik järnatom spelar genomsnittet ingen roll för dig – du är bara intresserad av den exakta massan av den specifika atomen.

3. Avrunda till massnummer. Massantalet är det totala antalet protoner plus neutroner i en atom i ett grundämne. Du kan enkelt hitta detta tal: ta bara atomvikten som anges i det periodiska systemet och runda av till närmaste heltal.

4. Beräkna antalet neutroner. Du vet nu att atomnumret = antalet protoner, och att masstalet = antalet protoner + antalet neutroner. För att ta reda på hur många neutroner det finns i ett grundämne måste du subtrahera atomnumret från masstalet. Här är några exempel:

5. Förstå vad isotoper är. En isotop är en specifik form av ett grundämne med ett visst antal neutroner. När en kemifråga talar om "bor-10" eller "B" talar de om grundämnet bor med masstalet 10. Använd detta massnummer istället för värdet för "typiskt" bor.
Tips
- Vissa tyngre grundämnen har atomvikter inom parentes eller parentes. Detta betyder att atomvikten är den exakta massan av den mest stabila isotopen, snarare än genomsnittet av flera isotoper. (Detta har ingen effekt på grundämnets atomnummer.)
Оцените, пожалуйста статью