K Skal (inre): max 2 elektroner. L Skal: max 8 elektroner. M Shell: max 18 elektroner. N Skal: max 32 elektroner. O Skal: max 50 elektroner. P Skal (yttre): max 72 elektroner. 
Om valensskalet är fullt så är elementet stabilt. Om valensskalet inte är fullt är elementet reaktivt, vilket betyder att det kan bilda en kemisk bindning med atomen i ett annat element. Varje atom delar sina valenselektroner i ett försök att göra valensskalet fullt. 

Väte (H) och Helium (He) har båda 1 skal, medan Francium (Fr) har 7. Lantaniderna och aktiniderna är grupperade och listade under huvudtabellen. Alla lantanider tillhör period 6, grupp 3 och alla aktinider tillhör period 7, grupp 3. 
Grupp 1: 1 valenselektron Grupp 2: 2 valenselektroner Grupp 13: 3 valenselektroner Grupp 14: 4 valenselektroner Grupp 15: 5 valenselektroner Grupp 16: 6 valenselektroner Grupp 17: 7 valenselektroner Grupp 18: 8 valenselektroner – förutom Helium, som har 2 

Grupp 3: 3 valenselektroner Grupp 4: 2 till 4 valenselektroner Grupp 5: 2 till 5 valenselektroner Grupp 6: 2 till 6 valenselektroner Grupp 7: 2 till 7 valenselektroner Grupp 8: 2 eller 3 valenselektroner Grupp 9: 2 eller 3 valenselektroner Grupp 10: 2 eller 3 valenselektroner Grupp 11: 1 eller 2 valenselektroner Grupp 12: 2 valenselektroner
Bestämma antalet valenselektroner
Valenselektroner finns i det yttersta skalet av ett element. Antalet valenselektroner i en atom avgör vilken typ av kemisk bindning detta element kan bilda. Det bästa sättet att ta reda på antalet valenselektroner är att använda grundämnenas periodiska system.
Steg
Metod 1 av 3: Del ett: Förstå elektronskal

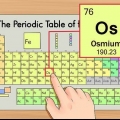
1. Grundämnenas periodiska system. Detta är en tabell med färgkoder, där varje cell visar ett element med sitt atomnummer och 1 till 3 bokstäver som symbol.

2. Hitta grundämnets atomnummer. Atomnumret är ovanför eller bredvid elementets symbol. Till exempel: Bor (B) har atomnummer 5, vilket betyder att det har 5 protoner och 5 elektroner.

3. Rita en enkel representation av en atom och placera elektronerna i omloppsbana runt kärnan. Dessa banor kallas även skal eller energinivåer. Det maximala antalet elektroner som kan vara i samma skal är fast, och skalen fylls från den innersta till den yttersta omloppsbanan.

4. Hitta antalet elektroner i det yttre skalet. Dessa är valenselektronerna.
Metod 2 av 3: Del två: Hitta valenselektroner i metaller utom övergångsmetaller

1. Numrera varje kolumn i det periodiska systemet, från 1 till 18. Väte (H) är överst i kolumn 1 och helium (He) är överst i kolumn 18. Dessa är de olika grupperna av element.

2. Numrera varje rad, från 1 till 7. Dessa är elementens perioder, och de motsvarar antalet skal eller energinivåer för en atom.

3. Leta reda på ett element som inte är en övergångsmetall. Övergångsmetaller finns i grupperna 3 till 12. Gruppnumren för de andra metallerna anger antalet valenselektroner.
Metod 3 av 3: Del tre: Hitta valenselektroner i övergångsmetaller

1. Hitta ett grundämne från grupperna 3 till 12, övergångsmetallerna.

2. Bestäm antalet valenselektroner baserat på gruppnumret. Dessa gruppnummer motsvarar ett möjligt antal valenselektroner.
Tips
- Övergångsmetaller kan ha valensskal som inte är helt fulla. Att bestämma det exakta antalet valenselektroner i övergångsmetaller kräver vissa principer för kvantteorin som ligger utanför denna artikels omfattning.
Förnödenheter
- Grundämnenas periodiska system
- Penna
- Papper
"Bestämma antalet valenselektroner"
Оцените, пожалуйста статью