Om bindningsordningen är noll kan molekylen inte bildas. De högre bindningsordningarna ger mer stabilitet till den nya molekylen. 


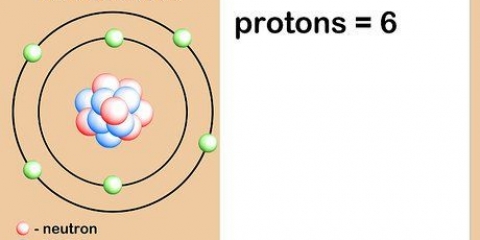
Beroende på storleken och komplexiteten hos en viss atom kan den ha en till fyra orbitaler. När det närmaste orbitala skalet är fullt, kommer nya elektroner att samlas i nästa orbitalskal sett från kärnan, tills det skalet också är fullt. Uppsättningen elektroner fortsätter i allt större orbitala skal, eftersom större atomer har fler elektroner än mindre atomer. 
Lewis-strukturen för diatomiskt kväve blir N≡N. Varje kväveatom har ett par elektroner och tre obundna elektroner. När två kväveatomer möts bildar de kombinerade sex obundna elektronerna en kraftfull trippelkovalent bindning. 

Bindande elektroner: Genom att lägga märke till hur fulla varje atoms orbitala skal är, kan du bestämma hur många av elektronerna i ett högre energitillstånd som kan fylla motsvarande atoms mer stabila, lägre energinivåer. Dessa "fyll"-elektroner kallas bindningselektroner. Antibindande elektroner: När två atomer försöker bilda en molekyl genom att dela elektroner, kommer vissa elektroner faktiskt att drivas till orbitala skal med högre energinivå eftersom orbitalskalen på lägre energinivå är fyllda. Dessa elektroner kallas antibindande elektroner.
Beräkna bindningsordning i kemi
På atomnivå är bindningsordningen antalet bundna elektronpar mellan två atomer. Diatomiskt kväve (N≡N), till exempel, har bindningsordning 3 eftersom det finns 3 kemiska bindningar mellan två kväveatomer. I molekylär orbitalteori definieras bindningsordningen också som hälften av skillnaden mellan antalet bundna och obundna elektroner. För ett tydligt svar, använd följande formel: Bindningsordning = [(antal elektroner som binder molekylära orbitaler) - (antal elektroner i antibindande molekylorbitaler)]/2.
Steg
Metod 1 av 3: Fastställ snabbt obligationsordningen

1. Känna till formeln. I molekylär orbitalteori definieras bindningsordningen som halva skillnaden mellan antalet bindande och antibindande elektroner. Bindningsordning = [(antal elektroner som binder molekylära orbitaler) - (antal elektroner i antibindande molekylorbitaler)]/2.

2. Vet att ju högre bindningsordningen är, desto stabilare är molekylen. Varje elektron som läggs till en bindande molekylorbital hjälper till att stabilisera den nya molekylen. Varje elektron som läggs till en antibindande molekylorbital kommer att destabilisera den nya molekylen. Skriv ner det nya energitillståndet som bindningsordningen för molekylen.

3. Tänk på ett enkelt exempel. Väteatomer har en elektron i s-skal och det skalet kan innehålla två elektroner. När två väteatomer binder samman, fyller var och en s-skal av den andra. Två bindande orbitaler bildas. Ingen av elektronerna tvingas flytta till nästa högre orbital, den sid-skal & ndash; så inga antibindande orbitaler bildas. Så ordningen för bindningen är  , och det är lika med 1. Detta bildar molekylen H2: vätgas.
, och det är lika med 1. Detta bildar molekylen H2: vätgas.
 , och det är lika med 1. Detta bildar molekylen H2: vätgas.
, och det är lika med 1. Detta bildar molekylen H2: vätgas.Metod 2 av 3: Visualisera Fundamental Bond Order

1. Bestäm obligationsordningen med ett ögonkast. En enkel kovalent bindning har bindningsordningen ett, dubbel kovalent bindning har bindningsordningen två, trippel kovalent bindning har bindningsordningen tre - och så vidare. I sin mest grundläggande form är bindningsordning antalet bundna elektronpar som håller ihop två atomer.

2. Tänk på hur atomer sätter ihop molekyler. De enskilda atomerna i en molekyl är sammanbundna av bundna elektronpar. Dessa elektroner kretsar kring en atoms kärna i "orbitaler" som var och en kan hålla bara två elektroner. Om en orbital inte är "fullständigt fylld" -- t.ex., den innehåller bara en elektron eller inga elektroner – då kan en obunden elektron binda till en motsvarande fri elektron från en annan atom.

3. Rita Lewis-strukturer. Detta är ett användbart sätt att visualisera hur atomerna i en molekyl är sammanbundna. Rita atomerna som deras bokstäver (t.ex. H för väte, Cl för klor). Ange bindningarna som linjer (t.ex., `-` för en enkelbindning, `=` för en dubbelbindning och `≡` för en trippelbindning). Markera de obundna elektronerna och elektronparen som punkter (exempel: C:). När du har ritat Lewis-strukturen, räkna antalet obligationer (obligationsordningen).
Metod 3 av 3: Beräkna bindningsordning för orbitalteori

1. Använd ett diagram över elektronomloppsskal som referens. Observera att varje skal är längre och längre från atomkärnan. Enligt entropin försöker energi alltid nå lägsta möjliga tillstånd. Elektronerna försöker alltid fylla de lägsta orbitala skalen som finns tillgängliga.

2. Vet skillnaden mellan bindande och antibindande orbitaler. När två atomer går samman för att bilda en molekyl vill de använda varandras elektroner för att fylla lägsta möjliga tillstånd i orbitalskalen. Bindande elektroner är i huvudsak elektroner som håller ihop och hamnar i det lägsta energitillståndet. Antibindande elektroner är de "fria" eller obundna elektronerna som trycks in i högre orbitala nivåer.
"Beräkna bindningsordning i kemi"
Оцените, пожалуйста статью