Eftersom atomer är utomordentligt små, arbetar forskare vanligtvis med atomer i större mängder som kallas kvarn. En mol är mängden av ett ämne med lika många atomer som det skulle finnas i 12 gram av isotopen kol-12. Detta antal är cirka 600 biljoner (6 gånger 10 till 23:e potensen) atomer, och är känd som Avogadros konstant, efter vetenskapsmannen som definierade den. 


En referensbok kommer att ge förhållanden baserade på alla kända mängder isotoper av ett grundämne, medan masspektrometern kommer att ge förhållanden för provet som testas. 
I exemplet ovan: 12 x 0,99 = 11,88 för kol-12 och 13 x 0,01 = 0,13 för kol-13. Den relativa atommassan är 11,88 + 0,13 = 12,01. (På grund av förhållandena mellan isotoper är de relativa atommassorna i det periodiska systemet sällan heltal.)
Beräkna atommassa
Atommassa är massan av en specifik isotop av en given atom, men den används också på fel sätt för att beskriva medelvikten av ett prov av olika isotoper av samma grundämne, vilket egentligen kallas relativ atommassa eller atomvikt. Vilket värde du än letar efter visar vi dig stegen för att beräkna atommassa och relativ atommassa.
Steg
Metod 1 av 2: Beräkna atommassa

1. Hitta grundämnets eller isotopens atomnummer. Atomnumret är antalet protoner i ett grundämne, och det ändras aldrig. Till exempel: alla väteatomer, endast och endast väteatomer, har en proton. Kol har atomnummer 6 eftersom dess kärna har sex protoner medan syre har atomnummer 8 eftersom dess kärna har åtta protoner.

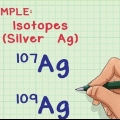
2. Bestäm antalet neutroner i kärnan. Antalet neutroner kan variera inom en atom - även om de är samma grundämne så finns det olika isotoper av det grundämnet. Två isotoper av samma grundämne kommer att ha samma antal protoner, men olika antal neutroner.

3. Ignorera antalet elektroner som kretsar kring kärnan. Massan av elektroner i en atom är försumbar jämfört med protonerna och neutronerna i kärnan.

4. Lägg till antalet protoner och neutroner. Detta är atommassan för den atomen.
Metod 2 av 2: Beräkna relativ atommassa (atomvikt)

1. Bestäm antalet isotoper i provet. Vilka isotoper som finns i provet kan bestämmas med hjälp av en masspektrometer.

2. Bestäm den relativa förekomsten av varje isotop i provet. Denna information kan erhållas genom masspektrometri eller från en uppslagsbok.

3. Multiplicera atommassan för varje isotop med dess förhållande i provet. I ett prov som innehåller kol-12 och kol-13, om 99 procent av provet är kol-12, multiplicera 12 med 0,99 och 13 med 0,01.

4. Lägg ihop resultaten. Summan är den relativa atommassan, eller atomvikten, av provet.
Tips
- Vissa isotoper är mindre stabila än andra och bryts ner till grundämnen med färre protoner och neutroner i sina kärnor samtidigt som de stöter bort delar av sig själva. Dessa isotoper kallas radioaktiva.
Förnödenheter
- Masspektrometer
- Kemisk referensbok
- Kalkylator
"Beräkna atommassa"
Оцените, пожалуйста статью