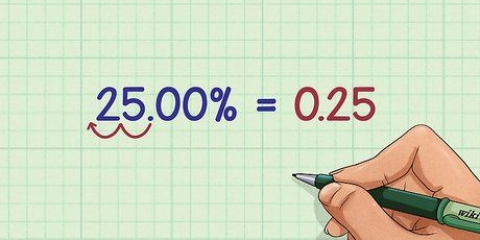Den uppmätta absorbansen mellan olika avläsningar kan variera beroende på koncentrationen av lösningen och formen på behållaren som används för att mäta intensiteten. Molar absorbans kompenserar för dessa variationer. 
Bered en lösning med en känd koncentration, c, för analys. Koncentrationsenheten anges i mol eller mol/liter. Till l för att hitta, mät längden på kyvetten. Enheten för banans längd är centimeter. Använd en spektrofotometer för att få absorbansavläsning a vid en given våglängd. Enheten för våglängd är meter, men de flesta våglängder är så små att de faktiskt mäts i nanometer (nm). Absorbansen har ingen enhet. 
Till exempel: med en 1 cm kyvett mäter du absorbansen av en lösning med en koncentration på 0,05 mol/L. Absorbansen vid en våglängd av 280 nm är 1,5. Vad är den molära absorbansen för denna lösning?? ɛ280 = A/lc = 1.5/(1 x 0.05) = 30 L mol cm 

Rita en linje mellan var och en av punkterna. Om mätningarna är korrekta ska punkterna bilda en rät linje som indikerar att absorbansen och koncentrationen motsvarar Beers lag. 
Ekvationen för en linjes lutning eller lutning är (Y2 - Y1)/(X2 - X1). Punkten högre på raden får 2 som sänkt och den lägsta punkten får 1 som sänkt. Till exempel är absorbansen vid en molarkoncentration av 0,2 0,27 och vid en molarkoncentration av 0,3 är absorbansen 0,41. Värdena på absorbansen är Y-värden medan koncentrationerna är X-värden. Med hjälp av ekvationen för en linje, beräknar vi: (Y2 - Y1)/(X2 - X1) = (0.41-0.27)/(0.3-0.2) = 0.14/0.1 = 1.4 är linjens lutning. 
Vi fortsätter med vårt exempel: om 1,4 är linjens lutning och banlängden är 0,5 cm, så är molabsorbansen 1,4/0,5 = 2,8 L mol cm.
Beräkna molar absorption
Molär absorbans, även känd som molär extinktionskoefficient, är ett mått på absorptionen av en viss våglängd av ljus av en kemikalie. Det låter dig göra jämförelser mellan föreningar utan att ta hänsyn till skillnaderna i koncentration eller lösningslängd under mätningar. Det används ofta inom kemi och bör inte förväxlas med extinktionskoefficienten eftersom det vanligtvis används inom fysik. Standardenheterna för molär absorbans är liter per molcentimeter (L mol cm).
Steg
Metod 1 av 2: Beräkna molabsorbansen med en ekvation

1. Förstå Beer-Lamberts lag för utrotning, A = lc. Standardekvationen för absorbans är A = lc, Sann a representerar mängden ljus som absorberas av provet för en given våglängd, ɛ är den molära absorbansen, l är avståndet som ljuset färdas genom lösningen, och c är koncentrationen av absorbenterna per volymenhet.
- Absorptionen kan också beräknas med hjälp av förhållandet mellan intensiteten hos ett referensprov och det okända provet. Detta ges av ekvationen A = log10(JagO/I).
- Intensiteten kan erhållas med en spektrofotometer.
- Absorbansen av en lösning ändras beroende på våglängden i lösningen. Vissa våglängder kommer att absorberas mer än andra beroende på lösningens sammansättning. Glöm inte att nämna vilken våglängd du använder för beräkningen.

2. Ordna om Beer-Lambert-ekvationen för att lösa molabsorbansen. Med hjälp av algebra kan vi dividera absorbansen med längden och koncentrationen, för att isolera den molära absorbansen på ena sidan av ekvationen: ɛ = A / lc. Nu kan vi använda denna grundläggande ekvation för att beräkna molabsorbansen för en given våglängd.

3. Få värdena för variablerna i ekvationen med hjälp av spektrofotometri. En spektrofotometer är en enhet som sänder en specifik våglängd av ljus genom ett ämne och känner av hur mycket ljus som kommer ut igen. En del av ljuset kommer att absorberas av lösningen och det återstående ljuset som sänds kan användas för att beräkna absorbansen för denna lösning.

4. Tillämpa värdena för variablerna på molabsorbansekvationen för att lösa. Använd de värden du fick för a, c och l, fyll i ekvationen ɛ = A / lc i. Multiplicera l av c och dela a sedan genom produkten, för att få den molära absorbansen.
Metod 2 av 2: Beräkna den molära absorbansen med bästa lösningen

1. Mät intensiteten av genomsläppt ljus genom olika koncentrationer av en lösning. Gör tre eller fyra koncentrationer av en lösning. Använd en spektrofotometer för att mäta absorbansen av en lösningskoncentration vid en given våglängd. Börja med den lägsta koncentrationen av lösningen och arbeta dig upp till den högsta. Ordningen är inte viktig, men det är viktigt vilken absorbans som hör till vilken beräkning.

2. Rita koncentrationen mot absorbansen på en graf. Använd värdena som erhålls med spektrofotometern för att plotta a Diagram. För varje enskilt värde sätts koncentrationen på x-axeln och absorbansen på y-axeln.

3. Särskildbacke av linjen med bästa passform, med hjälp av punkterna på grafen. För att beräkna lutningen på linjen, dividera absorbansen med koncentrationen. Använd två av dina grafpunkter, subtrahera X- och Y-värdena och beräkna sedan Y/X.

4. Dela linjens lutning med längden på banan (kyvettens djup/bredd) för att beräkna molarabsorbansen. Det sista steget för att beräkna den molära absorbansen med datapunkter är att dividera med längden på banan. Detta är kyvettens djup som används i spektrofotometern.
"Beräkna molar absorption"
Оцените, пожалуйста статью