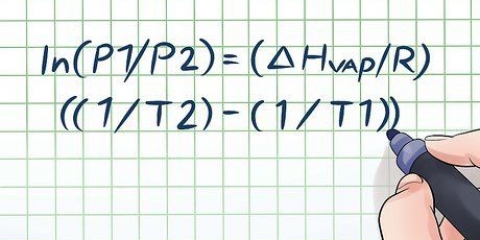Till exempel: Till exempel har isotopen Ag-107 (silver) en atommassa på 106,90509 amuse (atommassaenhet). Isotopen Ag-109 är något tyngre med en massa på 108,90470. De sista decimalerna kan skilja sig något beroende på källan. Inkludera inte siffror inom parentes efter mässan. 
Isotopen Ag-107 har en procentandel på 5,86 %. AG-109 är något mindre vanligt med en frekvens på 48,14 %. Detta betyder att en specifik mängd silver innehåller 51,86 % Ag-107 och 48,14 % Ag-109. Ignorera alla isotoper utan att ange procentandelen. Dessa isotoper förekommer inte naturligt på jorden. 
I exemplet är procenttalen: 51,86 / 100 = 0,5186 och 48,14 / 100 = 0,4814. 
Genomsnittlig atommassaAg = (massaAg-107 * procentAg-107) + (massaAg-109 * procentAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu. Slå upp elementet i det periodiska systemet för att kontrollera ditt svar. Den genomsnittliga atommassan skrivs vanligtvis under elementsymbolen. 


En vattenmolekyl har den kemiska formeln H2O, och innehåller alltså två väteatomer (H) och en syreatom (O). Väte har en genomsnittlig atommassa på 1,00794 amu. Syreatomer har en medelmassa på 15,9994 amu. Medelmassan av en molekyl av H2O är lika med (1,00794)(2) + 15,9994 = 18,01528 amu, ekvivalent med 18,01528 g/mol.
Beräkna den genomsnittliga atommassan
Genomsnittlig atommassa är inte ett direkt mått på en enskild atom. Istället är det medelmassan per atom av en specifik mängd av ett givet grundämne. Om du kan mäta massan av miljarder enskilda atomer kan du beräkna detta värde på samma sätt som medelvärdet. Lyckligtvis finns det en mer praktisk metod som bygger på observerad information om sällsyntheten hos olika isotoper.
Steg
Del 1 av 2: Beräkna medelatommassan

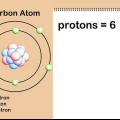
1. Förstå isotoper och atommassor. De flesta grundämnen förekommer naturligt i flera former eller isotoper. Den enda skillnaden mellan två isotoper av samma grundämne är antalet neutroner per atom, och därmed atommassan. Den genomsnittliga atommassan för ett element tar hänsyn till dessa variationer och ger dig medelmassan per atom i en given mängd av det elementet.
- Till exempel har grundämnet silver (Ag) två naturligt förekommande isotoper: Ag-107 och Ag-109 (eller Ag och Ag). Isotoper är uppkallade efter "massnumret" eller summan av protoner och neutroner i en atom. Detta betyder att Ag-109 har två extra neutroner per atom jämfört med Ag-107, och därför något mer massa.

2. Hitta massan för varje isotop. Du behöver två typer av information för varje isotop, som du kan slå upp i en uppslagsbok eller en onlineresurs, som t.ex webbelement.com. Den första är atommassan, eller massan av en atom av vilken isotop som helst. Isotoper med fler neutroner har mer massa.

3. Skriv ner mängden av varje isotop. Detta mått berättar hur vanlig isotopen är (som en procentandel av alla atomer i elementet). Du kan hitta detta i samma källa där du hittade massorna. Antalet isotoper måste läggas till 100 % (även om det kan vara något mindre på grund av avrundningsfel).

4. Konvertera procenttal till decimaler. Dividera procentandelen av en isotop med 100 för decimalvärdet.

5. Bestäm det viktade medelvärdet av massorna. Den genomsnittliga atommassan för ett grundämne med n isotoper lika (massaisotop 1 * procentisotop 1) + (massaisotop 2 * procentisotop 2) + ... + (massaisotop n * procentisotop n. Detta är ett exempel på ett "vägt medelvärde", vilket betyder att de vanligare (mer rikliga) massorna har en större effekt på resultatet. Så här använder du denna formel för silver:
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu.
Del 2 av 2: Använda resultatet

1. Konvertera massa till antal atomer. Den genomsnittliga atommassan talar om förhållandet mellan massan och antalet atomer i en specifik mängd av elementet. Detta är användbart i experimentell kemi, eftersom det är nästan omöjligt att räkna enskilda atomer, men lätt att mäta massa. Till exempel kan du väga ett silverprov och förutsäga att varje massa på 107,8677 amu innehåller en silveratom.

2. Konvertera till molmassa. Atommassenheter är mycket små, så kemister väger vanligtvis mängder atomer i gram. Lyckligtvis har dessa termer definierats för att göra konverteringen så enkel som möjligt. Du behöver bara multiplicera den genomsnittliga atommassan med 1 g/mol (molarmasskonstanten) för ett svar i g/mol. Till exempel innehåller 107,8677 gram silver i genomsnitt en mol silveratomer.

3. Bestäm den genomsnittliga molekylmassan. Eftersom en molekyl helt enkelt är en samling atomer kan du lägga till atomernas massor för att bestämma molekylens massa. Om du använder den genomsnittliga atommassan (snarare än massan av en viss isotop), är svaret den genomsnittliga molekylmassan som finns i en naturligt förekommande kvantitet. Här är ett exempel:
Tips
- Termen relativ atommassa används ibland som en synonym för genomsnittlig atommassa. Det finns dock en liten skillnad eftersom den relativa atommassan inte har några enheter; det är ett mått på massan i förhållande till C-12-kolatomen. Men så länge du använder atommassaenheter i din genomsnittliga massaberäkning, är de två värdena numeriskt identiska.
- Talet inom parentes efter en atommassa är osäkerheten för det slutliga talet. Till exempel: En atommassa på 1,0173(4) betyder att typiska prover har en felmarginal på ±0,0004. Du behöver inte ta hänsyn till detta om inte problemet kräver det.
- Med sällsynta undantag har grundämnen längre ner i det periodiska systemet en högre medelmassa än grundämnena före dem. Det här är ett snabbt sätt att kontrollera om dina svar är vettiga.
- 1 atommassaenhet definieras som 1/12 av massan av en C-12 kolatom.
- Förekomsten av isotoper är baserad på prover som förekommer naturligt på jorden. Ovanliga ämnen, som en meteorit eller ett prov som gjorts i ett labb, kan ha olika isotopförhållanden och därmed en annan genomsnittlig atommassa.
Varningar
- Atommassor representeras nästan alltid som en atommassaenhet (amu eller u) (även kallad Dalton eller Da). Sätt aldrig en annan massenhet (som kg) efter ett tal utan att konvertera det.
Förnödenheter
- Penna
- Papper
- Kalkylator
- Procentandelar av isotoper
- Atommassenheter för isotoper
"Beräkna den genomsnittliga atommassan"
Оцените, пожалуйста статью