Exempel: Anta att vi behöver hitta koncentrationen (i gram per liter) av en lösning gjord genom att lösa 1/2 tesked salt i 2 liter vatten. Vi vet också att 1 tsk salt är cirka 6 gram. I det här fallet är konverteringen enkel - multiplicera: 1/2 tesked x (6 gram/1 tesked) = 3 gram salt. 3 gram salt dividerat med 2 liter vatten = 1.5g/L Exempel: Antag att vi vill hitta molariteten för ovanstående saltlösning. Som sammanfattning har vi 3 gram salt (NaCl) i 2 liter vatten. Börja med att ta reda på molmassorna av Na och Cl genom att titta i det periodiska systemet. Na = ca 23 g/mol och Cl = ca 35,5 g/mol. Så MM för NaCl = 23 + 35,5 = 58,5 g/mol. 3 gram NaCl x (1 mol NaCl/58,5 g NaCl) = 0,051 mol NaCl. 0,051 mol NaCl / 2 liter vatten = .026 M NaCl Vad är molariteten för NaCL i en 400 ml lösning, erhållen genom att tillsätta 1.5 gram NaCl i vatten? Vad är koncentrationen, i ppm, av en lösning gjord genom att tillsätta 0,001 g bly (Pb) till 150 L vatten? (1 L vatten = 1000 gram) I det här fallet kommer volymen av lösningen att öka med en liten mängd genom att tillsätta ämnet, så du kan använda volymen av lösningsmedlet som volymen av lösningen. Hitta koncentrationen i gram per liter av en 0,1 L lösning gjord genom att tillsätta 1/2 mol KCl till vatten. Detta problem kräver att du arbetar framifrån och bakifrån och använder molmassan av KCL för att beräkna gram KCl i det lösta ämnet. Se till att all utrustning är förrengjord, sköljd med avjoniserat vatten och torka. Var uppmärksam: om reaktionen mellan lösningen i byretten och det lösta ämnet i kolven inte visar några tecken på reaktion, kommer du att göra det indikator måste lägga i baken. Dessa används inom kemi för att ge en visuell signal när en lösning når ekvivalenspunkten eller slutpunkten. Indikatorer används vanligtvis för titreringar som undersöker syra-bas- och redoxreaktioner, men det finns också flera andra indikatorer. Konsultera en lärobok i kemi eller Internet för att hitta en lämplig indikator för din reaktion. Om reaktionen resulterar i en förändring i pH eller potential, kan du sätta pH-läsare eller en potentiometer i kolven för att mäta hur den kemiska reaktionen fortskrider. För en mer exakt titrering, övervaka pH eller potential enligt ovan, notera hur reaktionen fortskrider varje gång efter tillsats av en liten mängd titrering. Rita lösningens surhet eller potential mot volymen av den tillsatta titranten. Du kommer att se skarpa förändringar i kurvans lutning vid reaktionens ekvivalenspunkter. Spela in den slutliga volymen i din byrett. Genom att subtrahera detta från startvolymen i byretten kan du hitta den exakta volymen av titranten du använde. Anta till exempel att vi använde 25 ml 0,5 M NaOH när vi titrerade en lösning av HCl i vatten till ekvivalenspunkten. HCl-lösningen hade en volym av 60 ml för titreringen. Hur många mol HCl finns det i vår lösning? För att komma igång, låt oss titta på den kemiska ekvationen för reaktionen mellan NaOH och HCl: NaOH + HCl > va2O + NaCl I detta fall reagerar 1 molekyl NaOH med 1 molekyl HCl för att producera vatten och NaCl. Så eftersom du tillsatte precis tillräckligt med NaOH för att neutralisera all HCl, kommer antalet mol NaOH som förbrukas i reaktionen att vara lika med antalet mol HCl i kolven. Så låt oss ta reda på hur mycket NaOH är i mol. 25 ml NaOH = 0,025 L NaOH x (0,5 mol NaOH/1 L) = 0,0125 mol NaOH. Eftersom vi har dragit slutsatsen från reaktionsekvationen att molerna NaOH som förbrukas i reaktionen = mol HCl i lösningen, vet vi nu att det finns 0,0125 mol HCl i lösningen. För att hitta molariteten i exemplet ovan, dividera mol HCl med volymen i kolven. 0,0125 mol HCl x (1/0,060 L) = 0,208 M HCl. För att omvandla molaritet till g/L, ppm eller procent av sammansättningen måste du omvandla molerna av ditt lösta ämne till massa (med hjälp av molmassan av ditt lösta ämne.) För ppm och procentandel av föreningen måste du också omvandla volymen av din lösning till massa (med en omvandlingsfaktor som densitet, eller bara genom att väga den), och sedan multiplicera resultatet med 10 respektive 10. 

Titrera silvernitratet från en byrett eller liten injektionsnål in i akvarieprovet tills lösningen blir grumlig. Med ett så litet urval är det viktigt att exakt bestäm hur mycket silvernitrat du har tillsatt – studera varje droppe noggrant. 
Antag att det finns 3 ml av 0,25 M AgNO3 behövdes för att reaktionen skulle ta slut och vattnet inte grumlade ytterligare. 3 mL x 0,25 M = 0,003 L x (.25 mol AgNO3/1 L) = 0,000075 mol AgNO3. I detta fall: 1 mol AgNO3 reagerar med 1 mol NaCl. Men om 1 mol titrant reagerar med 2 mol av vårt lösta ämne, då skulle vi multiplicera molerna av vår titrant med 2 för att få molerna av vårt lösta ämne. Däremot, om 2 mol av vår titrant reagerar med 1 mol av vårt lösta ämne, så delar vi antalet mol av titranten med två. Dessa regler motsvarar proportionellt 3 mol titrant och 1 mol löst ämne, 4 mol titrant och 1 mol löst ämne, etc. samt 1 mol titrant och 3 mol löst ämne, 1 mol titrant och 4 mol löst ämne, etc. MM Na = 22.990. MM Cl = 35.453. 22,990 + 35,453 = 58,443 g/mol 0,000075 mol NaCl x 58,442 g/mol = 0,00438 mol NaCl. Var uppmärksam: Om det finns mer än en av en sorts molekyl i en atom, måste du lägga till molmassan för den atomen flera gånger. Till exempel, om du tar den molära massan av AgNO3, Om du vill hitta det måste du lägga till massan eller syret tre gånger eftersom det finns tre syreatomer i molekylen. Salthalten i havsvatten är cirka 35 g NaCl/L. Vårt akvarium är inte alls tillräckligt salt för havsfiskar.
Bestämma koncentrationen av en lösning
I kemi eller kemi a lösning en homogen blandning av två saker -- a löst ämne och a lösningsmedel eller lösningsmedel där ämnet är löst. Koncentration är ett mått på mängden löst ämne i ett lösningsmedel. Det kan finnas många skäl för att bestämma koncentrationen av en lösning, men kemin inblandad är densamma oavsett om du testar klorhalten i en simbassäng eller utför en livräddande analys på ett blodprov. Den här guiden kommer att lära dig några grundläggande delar av lösningskemi och sedan gå igenom proceduren för en vanlig, praktisk tillämpning - underhåll av akvariet.
Steg
Del 1 av 3: Grunderna för koncentrationer
1. Notering av koncentrationer. En koncentration av ett ämne är mängden av det lösta ämnet dividerat med mängden lösningsmedel. Men eftersom det finns olika sätt att uttrycka mängden av ett visst ämne är det också möjligt att uttrycka en koncentration på olika sätt. Här är de vanligaste stavningarna:
- Gram per liter (g/L.) Massan av ett löst ämne i gram löst i en given volym av en lösning (vilket inte nödvändigtvis är detsamma som lösningsmedlets volym.) Används vanligtvis för lösningar av fasta ämnen i flytande lösningsmedel.
- Molaritet (M.) Antalet mol av ett löst ämne dividerat med lösningens volym.
- Miljondelar (ppm.) Förhållandet mellan antalet partiklar (vanligtvis i gram) av ett löst ämne per en miljon delar av en lösning multiplicerat med 10. Används vanligtvis för mycket utspädd lösning i vatten (1 L vatten = 1000 gram.)
- Procent av sammansatt tyg. Förhållandet mellan partiklar (igen i gram) av ett löst ämne per 100 partiklar av en lösning, uttryckt i procent.
2. Vet vilken data du behöver för att hitta en koncentration. Förutom molaritet (se nedan), kräver de vanliga stavningarna av en koncentration som anges ovan att du känner till massan av det lösta ämnet och massan eller volymen av den resulterande lösningen. Många kemiproblem som kräver att man hittar koncentrationen av en lösning ger dig inte denna information. Om så är fallet måste du arbeta med det du vet för att få denna information.
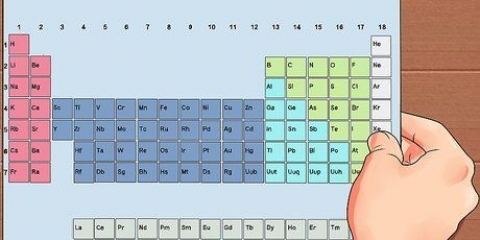
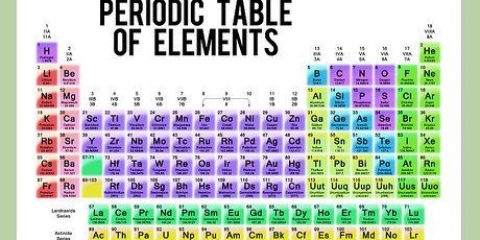
3. Lär dig hur man beräknar molaritet. Molaritet kräver att du känner till mol av ditt lösta ämne, men du kan enkelt härleda detta om du vet massan av det lösta ämnet och dess kemiska formel. Varje kemiskt element har ett känt "molär massa" (MM) – en specifik massa för en mol av det elementet. Dessa molära massor kan hittas i det periodiska systemet (vanligtvis under den kemiska symbolen och namnet på grundämnet.) Lägg helt enkelt ihop molmassorna för komponenterna i det lösta ämnet för att beräkna molmassan. Multiplicera sedan den kända massan av det lösta ämnet med (1/MM av ditt lösta ämne) för att hitta mängden av ditt lösta ämne i mol.
4. Öva standardövningar för att beräkna koncentrationer. Ovanstående kunskap är allt du behöver för att beräkna koncentrationerna i enkla situationer. Om du känner till lösningens massa eller volym och mängden tillsatt löst ämne från början, eller kan härleda detta från informationen i övningen, bör du enkelt kunna beräkna koncentrationen av en lösning. Skapa övningar för att förbättra dina färdigheter. Se exempel på uppdragen nedan:
Del 2 av 3: Titrering
1. Förstå när en titrering ska tillämpas. Titrering är en teknik som används av kemister för att beräkna mängden löst ämne som finns i en lösning. För att utföra en titrering tillhandahåller du en kemisk reaktion mellan det lösta ämnet och ett annat reagens (vanligtvis också löst). Eftersom du vet den exakta mängden av ditt andra reagens och du känner till den kemiska ekvationen för reaktionen mellan reagenset och det lösta ämnet, kan du beräkna mängden av ditt lösta ämne genom att mäta hur mycket av reagenset du behöver för reaktionen med det lösta ämnet komplett.
- Så titreringar kan vara mycket användbara när man beräknar koncentrationen av en lösning om du inte vet hur mycket löst ämne som tillsattes i princip.
- Om du vet hur mycket av ett löst ämne som finns i lösningen, behöver du inte titrera – mät bara volymen av din lösning och beräkna koncentrationen, som beskrivs i del 1.
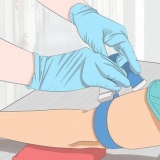
2. Ställ in din titreringsutrustning. För att utföra noggranna titrering behöver du ren, noggrann och professionell utrustning. Använd en Erlenmeyer-kolv eller bägare under en kalibrerad byrett, fäst vid en byretthållare. Byrettens pip måste passa in i kolvens eller bägarens hals utan att vidröra väggarna.
3. Fyll kolven och byretten. Mät noggrant en liten mängd av den okända lösningen. När ämnet är upplöst sprids det jämnt i lösningsmedlet, så koncentrationen av detta lilla prov av lösningen kommer att vara densamma som i den ursprungliga lösningen. Fyll din byrett med en lösning med känd koncentration som kommer att reagera med din lösning. Anteckna den exakta volymen av lösningen i byretten – subtrahera den slutliga volymen för att hitta den totala lösningen som används i reaktionen.
4. Börja med titreringen. Tillsätt gradvis en lösning från byretten (de "titrant") i kolven. Använd en magnetomrörare eller glasomrörare för att försiktigt blanda lösningen medan reaktionen pågår. Om din lösning reagerar synligt bör du se vissa tecken på att en reaktion är på gång - färgförändring, bubblor, rester etc. Om du använder en indikator kan du se en färgförändring för varje droppe som hamnar i kolven genom byretten.
5. Sakta ner din titrering. När din kemiska reaktion närmar sig slutpunkten, sakta ner titreringen tills den fortskrider droppe för droppe. Om du använder en indikator kan du märka att färgblinkarna håller längre. Fortsätt nu att titrera så långsamt som möjligt tills du kan bestämma den exakta droppen som gör att din reaktion når slutpunkten. När det gäller en indikator letar man i allmänhet efter den tidigaste möjliga ihållande färgförändringen i reaktionen.
6. Beräkna mängden löst ämne i din lösning. Använd den kemiska ekvationen för reaktionen mellan din titrant och lösningen för att hitta mol löst ämne i din kolv. När du har hittat molerna löst ämne kan du helt enkelt dividera med volymen av lösningen i kolven för att hitta lösningens molaritet, eller omvandla molarna till gram och dividera med lösningens volym, för att få koncentration i g/L. Detta kräver lite grundläggande kunskaper i stökiometri.
7. Beräkna koncentrationen av din lösning. Nu när du vet mängden löst ämne i din lösning är det lätt att hitta koncentrationen i form av molaritet. Dela helt enkelt molerna löst ämne i lösningen med volymen av lösningsprovet (inte volymen av den större kvantiteten du provade.) Resultatet är molariteten hos din lösning!
Del 3 av 3: Bestämning av salthalt i ett akvarium

1. Ta ett vattenprov från ditt akvarium. Spela in volymen noggrant. Om möjligt, mät volymen i SI-enheter som mL - dessa är lätta att omvandla till L.
- I detta exempel testar vi vattnet i akvariet för salthalt, koncentrationen av salt (NaCl) i vattnet. Antag att vi tar ett vattenprov för detta ändamål från 3 ml från akvariet och ställ sedan in det slutliga svaret som ska ges in g/L.

2. Titrera vattenprovet. Välj en titrant som ger en tydlig reaktion i det lösta ämnet. I det här fallet använder vi en lösning av 0,25 M AgNO3 (silvernitrat), en förening som producerar ett olösligt klorsalt när det reagerar med NaCl i följande reaktion: AgNO3 + NaCl > NaNO3 + AgCl. Saltet (AgCl) kommer att synas som en grumlig, vit rest som kommer att flyta och kan separeras från lösningen.

3. Fortsätt tills kommentaren slutar. När silvernitratet slutar grumla lösningen kan du registrera det tillsatta antalet ml. Titrera AgNO3 väldigt långsam och observera lösningen noga, särskilt när slutpunkten närmar sig.
4. Bestäm antalet mol av titranten. Detta steg är enkelt - multiplicera volymen titrant du tillsatt med molariteten. Detta kommer att ge dig antalet mol titrant som används.
5. Bestäm antalet mol av ditt lösta ämne. Använd reaktionsekvationen för omvandlingen av antalet mol AgNO3 till mol NaCl. Reaktionsekvationen är: AgNO3 + NaCl > NaNO3 + AgCl. Eftersom 1 mol AgNO3 reagerar med 1 mol NaCl, vi vet nu att antalet mol NaCl i vår lösning = antalet mol AgNO3 som har lagts till: 0,000075 mol.
6. Konvertera ditt lösta antal mol till gram. För att göra detta måste du beräkna molmassan av det lösta ämnet och multiplicera det med antalet mol av ditt lösta ämne. För att hitta molmassan av NaCl, använd det periodiska systemet för att hitta och lägga ihop atomvikterna för salt (Na) och Klorid (Cl).
7. Beräkna slutkoncentrationen. Vi har massan av vårt lösta ämne i gram och vi vet volymen av testlösningen. Allt vi behöver göra nu är att dela: 0,00438 g NaCl/0,003 L = 1,46 g NaCl/L
Tips
- Även om det lösta ämnet och lösningsmedlet kan finnas i olika tillstånd (fast, flytande eller gas) om de separeras, kommer lösningen som bildas när ämnet löser sig att vara i samma tillstånd som lösningsmedlets tillstånd.
- Ag + 2 HNO3 → AgNO3 + NO2 + H2O
- Använd endast klar plast eller glas.
- Här är ett exempel på video:[1]
Varningar
- Förvara AgNO3-lösningen i en stängd, mörk flaska. Den är känslig för ljus.
- Var försiktig när du arbetar med starka syror eller baser. Se till att det finns tillräckligt med frisk luft i rummet.
- Använd skyddsglasögon och handskar.
- Om du vill få tillbaka silvret, vänligen notera följande: Cu(s) + 2 AgNO3 (aq) → Cu(NO3)2 + 2 Ag (s) Kom ihåg att (s) betyder solid.
Оцените, пожалуйста статью