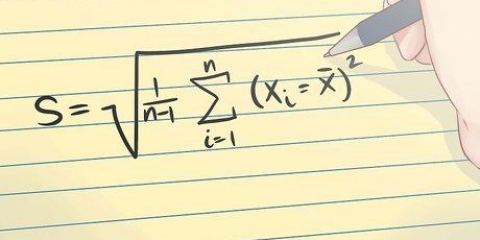I exemplet ovan, anta att du lägger väte och syre i kalorimetern, förseglade den och noterade en temperatur (T1) på 150K (vilket är mycket lågt). 

Antag i exemplet att den andra temperaturen är (T2) eller 95K. 
I exemplet beräknar du ∆T enligt följande:
∆T = T2 – T1 = 95K – 185K = -90K 
I exemplet ovan använder du väte och syre, som har en molmassa på 2g respektive 32g. Eftersom du har 2 mol väte och använde 1 mol syre, kan du beräkna den totala massan av reaktanterna enligt följande:
2x(2g) + 1x(32g) = 4g + 32g = 36g 
I formeln är m den totala massan av reaktanterna; s är den specifika värmen, som också är konstant för alla grundämnen eller föreningar. I exemplet ovan är slutprodukten vatten, med en specifik värme på 4,2 JK-1 g-1. Reaktionens entalpin kan därför beräknas enligt följande:
∆H=(36g) x (4.2 JK-1 g-1) x (-90K)=-13608 J 
I exemplet ovan är det sista svaret -13608 J. Så detta är en exoterm reaktion som använder en betydande mängd energi.
Bestämning av entalpi för en reaktion
När du blandar kemiska komponenter, oavsett om det är i köket eller i ett kemiskt labb, skapar du nya ämnen, det vi kallar "produkter". Under dessa kemiska reaktioner kan värme absorberas från eller släppas ut i miljön. Värmeutbytet under en kemisk reaktion med omgivningen kallas entalpin för en reaktion, skriven som ∆H. För att hitta ∆H läs följande artikel.
Steg

1. Förbered reaktanterna för den kemiska reaktionen. För att korrekt mäta entalpin för en reaktion måste du först ha rätt mängd av varje reaktant.
- Anta till exempel att du vill hitta entalpin för reaktionen där vatten bildas av väte och syre: 2H2 (väte) + O2 (syre)→2H2O (vatten). För detta exempel, låt oss anta att vi har 2 mol väte och 1 mol syre.

2. Rengör reaktionskärlet. För att säkerställa att reaktionen sker utan kontaminering, rengör reaktionskärlet (vanligtvis en kalorimeter) som du tänker använda.

3. Placera en omrörarstav och en termometer i reaktionskärlet. Förbered blandningen efter behov och mät deras temperatur genom att hålla både omrörarstaven och termometern i dekalorimetern.

4. Häll reaktanterna i reaktionskärlet. När allt är väl förberett kan du lägga reaktanterna i kalorimetern. Stäng den direkt efteråt.

5. Mät temperaturen. Använd termometern placerad i kalorimetern, registrera omedelbart temperaturen efter tillsats av reaktanterna.

6. Fortsätt med kommentaren. Ge ämnena lite tid att reagera, rör om det behövs för att påskynda det exakt.

7. Mät temperaturen igen. När reaktionen är klar, registrera temperaturen igen.

8. Beräkna skillnaden i temperatur mellan T1 och T. Du skriver skillnaden som ∆T.
∆T = T2 – T1 = 95K – 185K = -90K

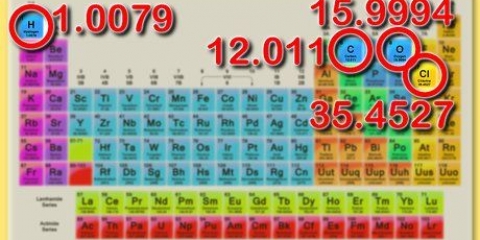
9. Bestäm reaktanternas totala massa. Om du vill beräkna den totala massan av reaktanterna behöver du molmassan av dina komponenter. Molar massa är en konstant; du kan hitta dessa i vanliga periodiska system eller andra kemitabeller.
2x(2g) + 1x(32g) = 4g + 32g = 36g

10. Beräkna reaktionens entalpi. När du har gjort detta kan du bestämma reaktionens entalpi. Formeln ser ut så här: ∆H = (m) x (s) x ( ∆T)
∆H=(36g) x (4.2 JK-1 g-1) x (-90K)=-13608 J

11. Anteckna resultatet. Om tecknet på ditt svar är negativt är reaktionen exoterm: värme går förlorad till miljön. Om tecknet på svaret är positivt, är reaktionen endoterm: värme absorberas från omgivningen.
Tips
- Dessa beräkningar görs i Kelvin (K) – en temperaturmätningsskala precis som Celsius. Om du vill konvertera Kelvin till Celsius, lägg bara till 273 grader: K = C + 273.
"Bestämning av entalpi för en reaktion"
Оцените, пожалуйста статью