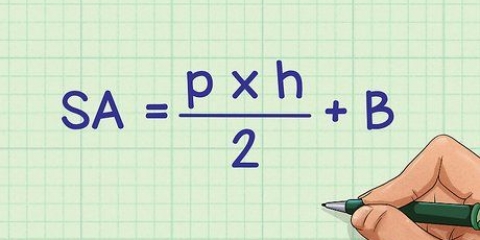I denna formel, n antalet mol, sid trycket, V volymen, t temperaturen i Kelvin och R gaskonstanten. Exempel: n=PV/RT=(0,984 atm x 1 L) / (0,08206 L atm mol-1 K-1 x 318,15 K)=0,0377 mol 
Exempel: 14,42 g / 0,0377 mol=382,49 g/mol 
Exempel: (12,0107g x 12) + (15,9994g x 1) + (1,00794g x 30)=144,1284 + 15,9994 + 30,2382=190,366g 
Exempel: 382,49 / 190,366=2,009 
Exempel: C12OH30 x 2=C24O2H60 

Exempel: 75,46 g C x (1 mol / 12,0107 g)=6,28 mol C 8,43 g O x (1 mol / 15,9994 g)=0,53 mol O 16,11 g H x (1 mol / 1,00794) = 15,98 mol H 
Exempel: Den minsta molära mängden är syre med 0,53 mol. 6,28 mol/0,53 mol=11,83 0,53 mol/0,53 mol=1 15,98 mol/0,53 mol=30,15 
Exempel: kvotformeln blir då C12OH30 11,83=12 1=1 30.15=30 


Bestämma molekylformeln för ett ämne
Molekylformeln är en viktig del av information om en kemikalie. Molekylformeln anger vilka atomer som finns i ämnet och hur många av varje. Du behöver kvotformeln för att beräkna molekylformeln och du behöver också veta att skillnaden mellan dessa två formler är ett heltal.
Steg
Del 1 av 3: Härledning av molekylformeln från en kvotformel

1. Känna till sambandet mellan molekylformeln och förhållandetsformeln. Förhållandeformeln säger något om förhållandet mellan atomer i en molekyl, till exempel två syreatomer på varje kolatom. Molekylformeln berättar hur mycket av var och en av dessa atomer som finns i molekylen. Till exempel en kol- och två syreatomer (koldioxid). Dessa två formler relaterar till varandra med ett heltal på ett sådant sätt att om förhållandets formel multipliceras med det förhållandet kommer molekylformeln att komma ut.

2. Beräkna antalet mol gas. Det betyder att du använder idealgaslagen. Du kan bestämma antalet mol baserat på tryck, volym och temperatur enligt data från experiment. Antalet mol kan beräknas med formeln: n=PV/RT.

3. Beräkna gasens molekylvikt. Detta kan endast göras när antalet mol som finns i gasen är känt, med hjälp av den ideala gaslagen. Du måste också veta hur många gram av en gas som finns. Dela sedan antalet gram gas med antalet mol av gasen som finns för att bestämma molekylmassan.

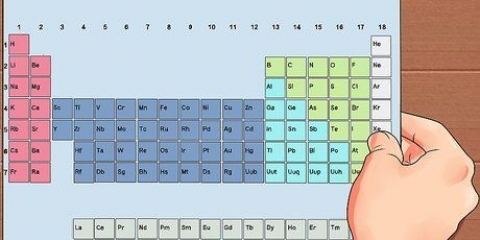
4. Lägg samman atommassorna för alla atomer i förhållandets formel. Varje atom i förhållandets formel har sin egen atommassa. Detta värde kan hittas längst ner i elementets ruta, i det periodiska systemet. Lägg samman dessa massor för att få massan av förhållandets formel.

5. Bestäm förhållandet mellan molekylmassan och förhållandets formel. Detta låter dig bestämma hur ofta massan går in i den faktiska molekylen enligt förhållandets formel. Om du vet detta så vet du också hur många gånger kvotformeln går in i molekylformeln. Detta bör vara ett heltal. Om förhållandet inte är ett heltal måste du avrunda det.

6. Multiplicera kvotformeln med kvoten. Multiplicera sänkningarna av förhållandets formel med förhållandet. Detta kommer att ge dig den molekylära formeln. Observera att för alla substanser med förhållandet `1` kommer förhållandeformeln och molekylformeln att vara densamma.
Del 2 av 3: Bestämma förhållandets formel

1. Bestäm massan av varje närvarande atom. Ibland kommer massan av varje atom att anges. Vid ett annat tillfälle anges endast massan i procent. Om så är fallet, antag att det är ett prov på 100 g av ämnet. Med detta kan du skriva massprocenten som faktisk massa i gram.
- Exempel: 75,46 g C, 8,43 g O, 16,11 g H

2. Konvertera massorna till antalet mol. Du måste omvandla molekylmassan för varje grundämne till mol. För att göra detta, dividera molekylmassan med atommassan för varje respektive element. Du kan hitta atommassan längst ner i det elementets ruta i det periodiska systemet.

3. Dividera varje molarvärde med det minsta molarvärdet. Du måste dela molerna av varje enskilt grundämne med den minsta molära mängden av alla grundämnen som finns i föreningen. Det låter dig bestämma de enklaste molförhållandena. Detta är giltigt eftersom det element som finns i minst mängd är satt till "1", och det ger respektive proportioner av de andra elementen i föreningen.

4. Avrunda molarvärdena till heltal. Dessa siffror blir siffrorna för förhållandets formel. Avrunda till närmaste heltal. Efter att ha bestämt dessa siffror kan du skriva ner kvotformeln.
Del 3 av 3: Förstå den kemiska formeln

1. Förstå hur en kvotformel fungerar. En kvotformel ger dig information om förhållandet mellan en atom och en annan i en molekyl. Detta ger dig ingen information om exakt hur många atomer som finns i molekylen. Förhållandeformeln ger dig heller ingen information om strukturen och bindningen av atomerna i en molekyl.

2. Vet vad en molekylformel säger dig. Liksom förhållandetsformeln ger den molekylära formeln dig inte information om bindningen och strukturen hos en molekyl. Men till skillnad från förhållandetsformeln ger molekylformeln dig information om hur mycket av varje atom som finns i molekylen. Förhållandeformeln och molekylformeln är relaterade till varandra enligt ett heltalsförhållande.

3. Förstå strukturformler. Strukturformler ger ännu mer information än molekylformler. Förutom att ange antalet atomer i en molekyl, ger strukturformler dig också information om molekylens bindningar och struktur. Denna information är avgörande för att förstå hur molekylen kommer att reagera.
Tips
- Läs uttalandet (eller uppgifterna) noggrant.
Varningar
- Blanda inte ihop förhållandets formel och molekylformeln.
Förnödenheter
- Grundämnenas periodiska system
- Kalkylator
- Penna
- Papper
Оцените, пожалуйста статью