Inom kemi betyder termerna "oxidation" och "minskning" de reaktioner där en atom (eller en grupp av atomer) förlorar respektive får elektroner. Oxidationstal är siffror som tilldelas atomer (eller grupper av atomer) för att hjälpa kemister att kontrollera hur många elektroner som är tillgängliga för att förskjutas, och om givna reaktanter oxiderar eller minskar under en reaktion. Processen att tilldela oxidationstal till atomer kan variera från det mycket enkla till det mer komplexa, beroende på atomernas laddning och den kemiska sammansättningen av molekylerna de ingår i. För att komplicera saken kan vissa atomer ha flera oxidationstal. Lyckligtvis styrs tilldelning av oxidationsnummer av väldefinierade, lätta att följa regler, men en grundläggande förståelse för kemi och algebra kommer att göra det mycket lättare att använda dessa regler.
Steg
Del 1 av 2: Tilldela oxidationstal baserat på kemiregler
1.
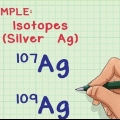
Bestäm om ämnet i fråga är elementärt. Fria, obundna atomer har alltid ett oxidationstal på 0. Detta gäller både atomer som består av en enda atom och atomer vars elementarform är diatomisk eller polyatomisk.
- Till exempel, Al(s) och Cl2 båda har oxidationstalet 0 eftersom de inte är sammansatta atomer.
- Observera att svavel i sin elementära form, S8 (oktasulfur), även om det är oregelbundet, har också ett oxidationstal på 0.
2. Bestäm om ämnet i fråga är en jon. Joner har oxidationstal lika med deras laddning. Detta gäller både för obundna joner och joner som ingår i en sammansatt jon.
Till exempel har jonen Cl ett oxidationstal -1.Cl-jonen har fortfarande ett oxidationstal på -1 när det ingår i föreningen NaCl. Eftersom Na-jonen per definition har en laddning på +1 vet vi att Cl-jonen har en laddning på -1, så oxidationstalet är fortfarande -1.3. När det gäller metalljoner är det bra att komma ihåg att flera oxidationstal är möjliga. Många metaller kan ha mer än en landning. Till exempel kan metalljärnet (Fe) vara en jon med laddning +2 eller +3. laddningen av metalljoner (och därmed även deras oxidationstal) kan bestämmas i förhållande till laddningen av de andra atomerna i den sammansättning som de ingår i, eller, när de skrivs som text, genom notationen i romerska siffror (t.ex. som i betydelsen: "Järn(III)jonen har en laddning på +3.").
Låt oss till exempel undersöka en förening som innehåller en aluminiumjon. Föreningen AlCl3 har en laddning 0. Eftersom vi vet att Cl-joner har en laddning på -1 och det finns 3 Cl-joner i föreningen, måste Al-jonen ha en laddning på +3, så att laddningen för alla joner adderade är 0. Så oxidationstalet för Al är +3.4. Tilldela syre ett oxidationstal -2 (med undantag). I nästan alla fall har syreatomer ett oxidationstal på -2. Det finns några undantag från denna regel:
När syre är i elementärt tillstånd (O2), då är oxidationstalet 0, vilket är fallet för alla elementära atomer.När syre ingår i peroxid, då är oxidationstalet -1. Peroxider är en klass av sammansatta ämnen som har en syre-syrebindning (eller peroxidanjonen O2). Till exempel, i molekylen H2O2 (väteperoxid), syre har ett oxidationstal (och en laddning) på -1.Dessutom, när syre är en del av en superoxid, är oxidationstalet -0.5 är.När syre är bundet till fluor är oxidationstalet +2. Se fluorregeln nedan för mer information. I (O2f2) är detta +1.5. Tilldela ett oxidationstal på +1 till väte (med undantag). Liksom med syre beror oxidationstalet för väte på undantagsfall. I allmänhet har väte ett oxidationstal +1 (förutom i elementär form, H2). Men i fallet med en speciell förening som kallas hybrider, har väte ett oxidationstal på -1.
Till exempel från H2Åh, vi vet att väte har ett oxidationstal på +1 eftersom syre har en laddning på -2 och vi behöver 2 +1 laddningar för att göra en förening med en total laddning på noll. Men i fallet med natriumhydrid, NaH, har väte ett oxidationstal på -1 eftersom Na-jonen har en laddning på +1 och, för att göra den totala laddningen av föreningen 0, har väte en laddning (och därmed ett oxidationstal ) av - 1.6. Fluor har alltid ett oxidationstal på -1. Som nämnts ovan kan oxidationstalen för vissa grundämnen variera på grund av olika faktorer (metalljoner, syreatomer i peroxider, etc.). Fluor, å andra sidan, har ett oxidationstal på -1, och det förändras aldrig. Detta beror på att fluor är det mest elektronegativa grundämnet, eller med andra ord, det är det grundämne som är minst villigt att ge upp elektroner och mest sannolikt tar över elektroner från andra atomer. Därför kommer oxidationstalet inte att ändras.
7. Oxidationstalen i en förening är lika med laddningen av föreningen. Oxidationstalen för alla atomer i en förening är lika med laddningen av den föreningen. Till exempel, om en förening inte har någon laddning, blir summan av alla oxidationstal noll; om föreningen är en polyatomisk jon med en laddning på -1, måste oxidationstalen som adderas vara lika med -1 osv.
Det här är ett bra sätt att kontrollera ditt svar - om oxidationstalen för en förening inte stämmer överens med laddningen för den föreningen, då vet du att du har gjort ett misstag.Del 2 av 2: Tilldela nummer till atomer utan reglerna för oxidationstal
1.
Hitta atomer utan regler för oxidationstal. Vissa atomer följer inte reglerna för att hitta oxidationstalen. Om en atom inte uppfyller ovanstående regler och du inte är säker på vad dess laddning är (till exempel om den är en del av en större förening och den individuella laddningen är okänd), kan du hitta oxidationstalet för den atomen genom eliminering. Först bestämmer du oxidationen av varannan atom i föreningen. Sedan löser du summan för det okända i ekvationen, baserat på föreningens totala laddning.
- Till exempel i kompositen Na2SÅ4, laddningen av svavel (S) är okänd - det är inte i elementär form, så det är inte 0, men det är allt vi vet. Detta är en bra kandidat för att tillämpa denna metod för att algebraiskt bestämma oxidationstalet.
2. Bestäm de kända oxidationstalen för de andra grundämnena i föreningen. Med hjälp av reglerna för tilldelning av oxidationsnummer bestämmer vi vilka oxidationstal de andra atomerna i föreningen har. Notera undantag som O, H osv.
i Nac2SÅ4, vi vet, baserat på vår uppsättning regler, att Na-jonen har en laddning (och därmed ett oxidationstal) på +1 och att syreatomerna har ett oxidationstal på -2.3. Multiplicera antalet av varje atom med oxidationstalet. Nu när vi vet oxidationstalen för alla atomer utom de okända, måste vi tänka på att vissa av dessa atomer kan förekomma mer än en gång. Multiplicera varje koefficient (skriven i nedsänkt efter symbolen för atomen i föreningen) med oxidationstalet.
När det gäller Na2SÅ4, vi vet att det finns 2 Na-atomer och 4 O-atomer. Vi utför nu följande beräkning, 2 × +1, för att få oxidationstalet för Na, 2, och vi multiplicerar 4 × -2, oxidationstalet för O, -8.4. Lägg ihop resultaten. Addera resultaten av dessa multiplikationer ger oxidationstalet för föreningen,utan att ta hänsyn till oxidationstalet för den okända atomen.
I vårt exempel med Na2SÅ4, vi lägger till 2 till -8 för att få -6.5. Beräkna det okända oxidationstalet baserat på laddningen av föreningen. Du har nu all data för att hitta det okända oxidationstalet med hjälp av någon enkel algebra. Vi använder en ekvation och svaret från föregående steg, plus laddningen av föreningen. Med andra ord: (Summa av de okända oxidationstalen) +(det okända oxidationstalet du vill veta) = (laddningen av föreningen).
I exemplet med Na2SÅ4, vi löser detta på följande sätt:(Summa av kända oxidationstal) +(okänt oxidationstal du vill lösa) = (laddning av föreningen)-6 + S = 0S = 0 + 6S = 6. S har ett oxidationstal eller 6 i Nac2SÅ4.Tips
- Atomer i sin grundform har alltid ett oxidationstal 0. En jon som består av 1 atom har ett oxidationstal som är lika med laddningen. Grupp 1A-metaller såsom väte, litium och natrium har ett oxidationstal på +1; Grupp 2A-metaller, såsom magnesium och kalcium, har ett oxidationstal på +2. Både väte och syre kan ha 2 olika oxidationstal beroende på deras bindning.
- I en förening bör summan av alla oxidationstal vara lika med 0. Om det finns en jon med 2 atomer måste summan av oxidationstalen vara lika med jonens laddning.
- Det är mycket användbart att veta hur man läser det periodiska systemet och var man kan hitta metaller och icke-metaller.
Förnödenheter
- Grundämnenas periodiska system
- En internetuppkoppling
- En kemibok
- Papper, penna eller penna
- Kalkylator
"Beräkna oxidationstalet för ett ämne"